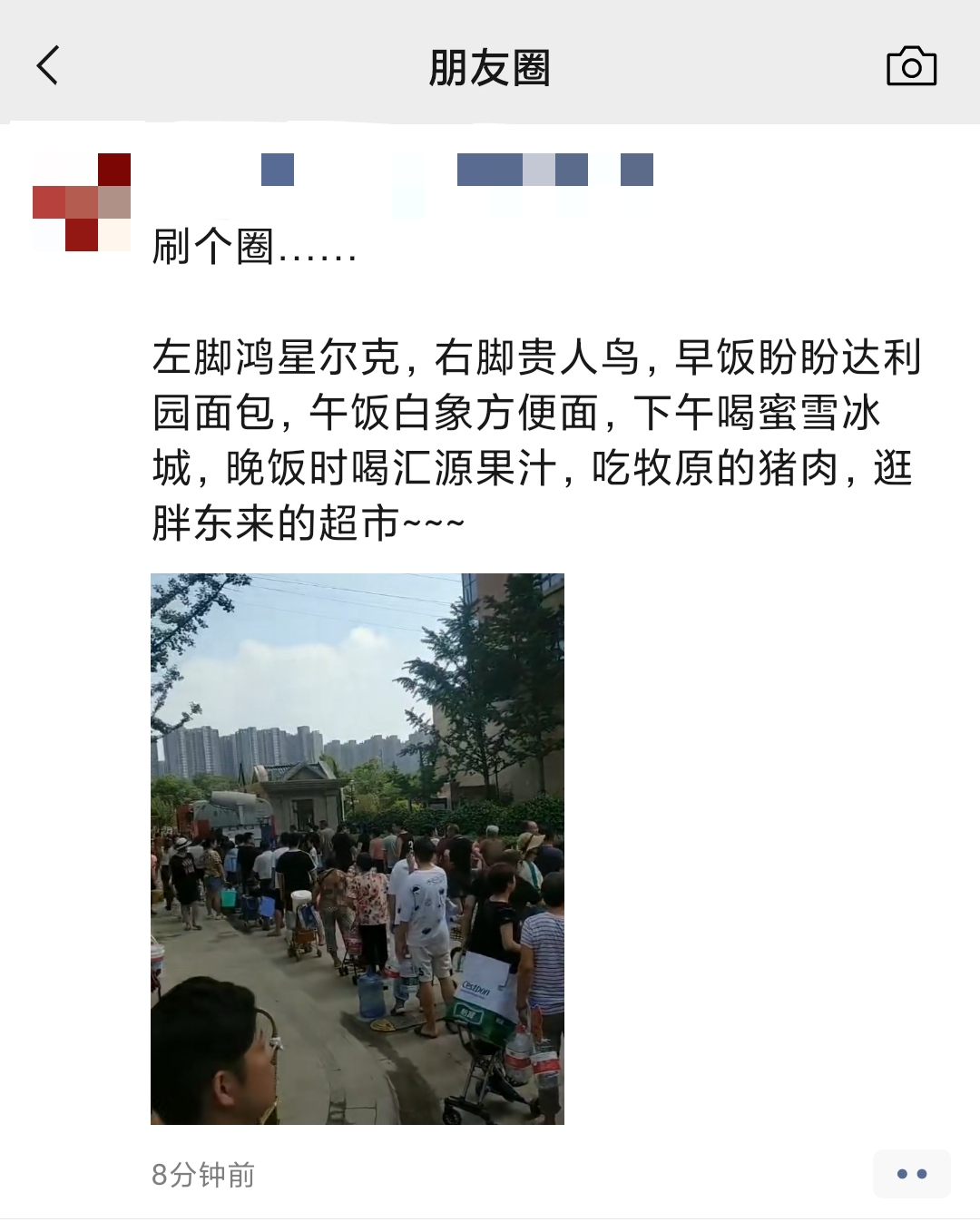
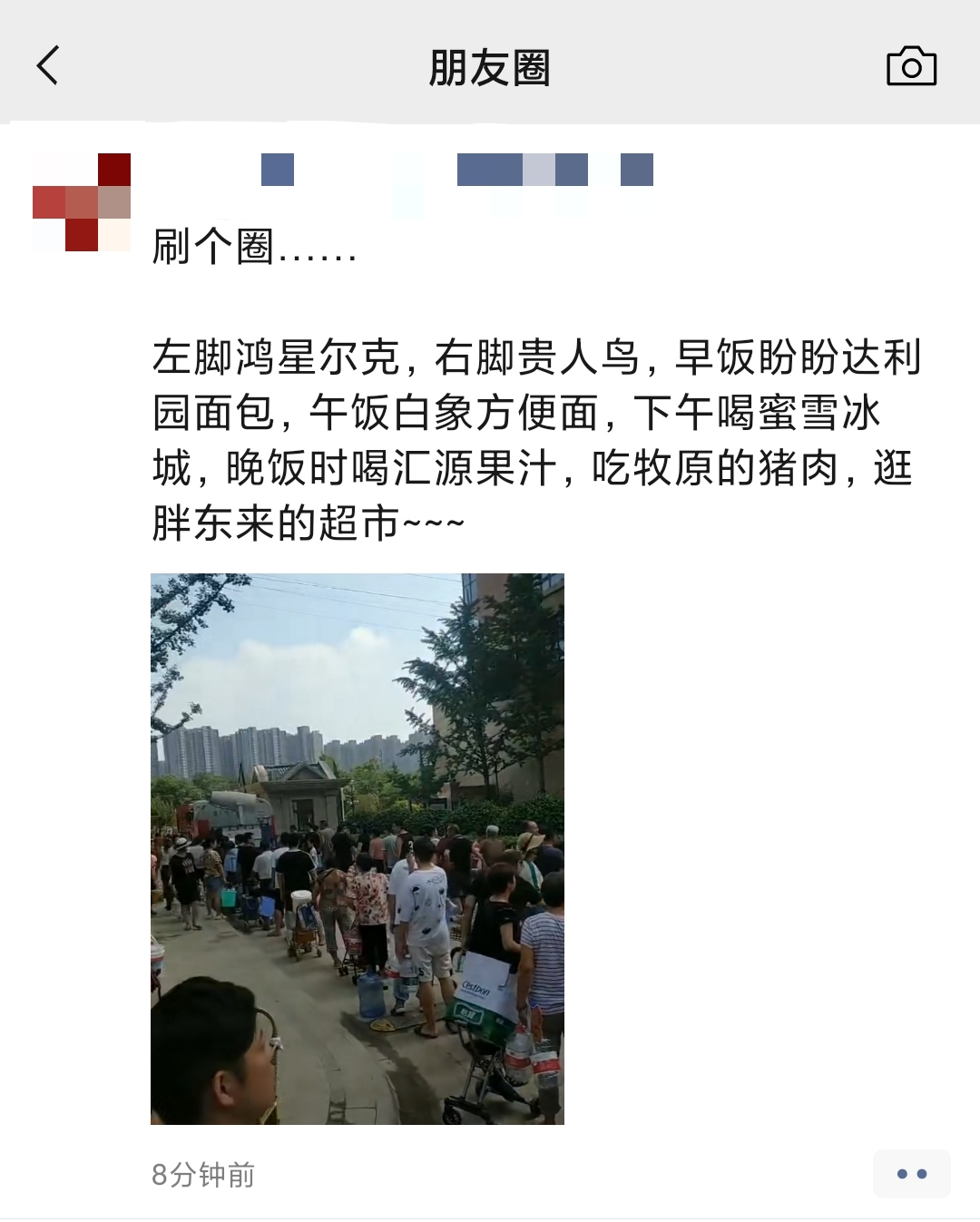
您的位置:首页 >财经 > 滚动 >
美国FDA计划到2076年才彻底公布新冠疫苗数据
据一份11月15日发布的法庭文件显示,美国食品药品监督管理局(FDA)有意在55年后,即到2076年再完全发布辉瑞公司提交给该政府机构、用来审批新冠疫苗的所有数据。
这起科学团体起诉FDA案件的原告由美国知名大学的数十位学者、教授和公共健康专业人士组成,声称在辉瑞向FDA提交用以申请新冠疫苗获批的全部文件公开之前,独立科学家们不能进行适当的分析,无法确保数百万美国人或自愿或被雇主要求接种的关键疫苗一定安全有效。
原告方认为,FDA违反了美国联邦法律规定,即“一旦获得许可,生物产品在使用许可审批过程中的数据和信息可立即公开披露”,这与FDA对新冠疫苗审批前后“完全透明”的承诺背道而驰。
FDA本周向美国得州地区的联邦法官请求,允许该机构每个月披露500页资料,而辉瑞公司提供给FDA的疫苗许可审批文件多达32.9万页。这也意味着,全部数据直到2076年才会“解密”。
原告方指责这种“龟速处理”是天方夜谭,因为从辉瑞开始制作用于疫苗许可的资料(2021年5月7日),到其成为美国首款获得全面接种授权的新冠疫苗(2021年8月23日)之间,美国FDA仅用了108天“进行所谓的密集、有力、彻底和完整的审查与分析,以确保疫苗在获得许可时是安全有效的”,现在却要求超过2万天的时间才能向公众提供全部文件。
原告称,自辉瑞疫苗获得FDA全面授权以来已过去近90天,自辉瑞开始制作许可审批所用的文件以来已过去了190多天,FDA仍未发布一页辉瑞提交的资料。这实际上等于美国政府给了辉瑞有效的法律诉讼豁免权,同时又通过购买疫苗向辉瑞输送了数十亿美元。
因此,他们希望法院下达命令,要求FDA以滚动方式提供辉瑞提交的所有文件和数据,以便在2022年3月3日或之前完全发布出来,即从本周一算起的108天后。
华尔街见闻曾提到,辉瑞于本月初发布的三季度财报全面超预期,其中新冠疫苗的收入130亿美元为营收最大贡献者,公司预计全年新冠疫苗销售将达360亿美元,较此前预期上调近8%。
辉瑞承认,新冠疫苗销售收入在三季度快速增长得益于接种人群的扩张。美国FDA已于10月底批准了辉瑞疫苗在5-11岁儿童中接种的紧急使用授权,此前仅批准了16岁以上的人群接种和12岁及以上儿童的紧急接种。
还有消息人士称,美国FDA可能最早于当地时间周四授权所有18岁以上的成年人接种辉瑞新冠加强针,将使有资格接种加强针的美国人数量增加数千万,也意味着更有利于辉瑞的疫苗销售。
辉瑞上周二向FDA提出普及加强针接种的申请,美国FDA曾于9月底授权65岁以上的老年人和其他有基础疾病、免疫力缺陷或在高感染危险环境中工作的成年人接种加强针。
实际上,辉瑞在今年8月还提出过更激进的加强针申请,希望在16岁及以上的美国人中普及接种。当时FDA外部顾问对此表示反对,特别提到第三针mRNA新冠疫苗在30岁以下年轻男性中诱发心肌炎等罕见副作用的风险,所以没有同意在更多人群中普及加强针的请求。
美国疾病控制与预防中心(CDC)的咨询委员会定于本周五下午开会讨论辉瑞新冠疫苗加强针,按照惯例,该委员会通常在美国FDA授权接种后再提出正式建议,这似乎表明FDA将在当地时间周四或周五早上批准辉瑞加强针的全面接种。
本周二,辉瑞还向美国FDA申请其新冠“神药”Paxlovid的紧急使用授权,临床试验证明这一口服药比中和抗体效果还好,曾一度令辉瑞股价飙升的同时,重创一众美国新冠疫苗股。
11月18日周四的最新消息显示,美国政府已同意以52.9亿美元购买辉瑞在研新冠口服药的1000万个疗程。辉瑞午盘一度转跌,随后转涨0.7%,即将连涨两日,若收盘站稳51美元将创历史新高,也是连续两天创纪录。
风险提示及免责条款 市场有风险,投资需谨慎。本文不构成个人投资建议,也未考虑到个别用户特殊的投资目标、财务状况或需要。用户应考虑本文中的任何意见、观点或结论是否符合其特定状况。据此投资,责任自负。